Ny kunskap om olösliga fibrer som kan förorsaka Skelleftesjukan
Felveckade, olösliga proteinfibrer kan orsaka sjukdom genom att över tid ansamlas i olika organ. Nu har Umeåforskare med kryoelektronmikroskopi beskrivit strukturen på proteinet transthyretin, TTR, i sin fiberform. Den nya kunskapen öppnar möjligheter att framställa läkemedel som inte bara förhindrar att fibrerna uppstår, utan även kan användas för att lösa upp redan bildade fibrer. Studien publiceras i Nature Communications.
Professor Elisabeth Sauer-Eriksson och första forskningsingenjör Irina Iakovleva, båda Kemiska institutionen vid Umeå universitet. Bild: Mattias Pettersson
Med kryoelektronmikroskopi kunde vi karakterisera strukturen ned på atomnivå, det vill säga en upplösning där positionerna av de enskilda atomerna i fibern kan detekteras.
Det humana proteinet transthyretin, TTR, finns i blodplasma där det fungerar som transportprotein för hormonet thyroxin. TTR i sin normala form är löslig och bryts ned på ett par dagar. TTR kan dock vecka om sin struktur för att sedan gå samman med andra felveckade TTR-strukturer för att bilda långa fibrer. Dessa fibrer är olösliga och ansamlas över tid i olika organ vilket ger upphov till sjukdom, bland annat den så kallade Skelleftesjukan.
Fibrerna ansamlas vanligtvis i hjärtat, men för vissa patienter ansamlas de även i ögats glaskropp vilket försämrar synen genom att den grumlas. Detta kan åtgärdas genom glaskroppskirurgi där den grumliga geléaktiga vätskan i ögat ersätts med en saltlösning. Detta gjordes för en patient vid Norrlands universitetssjukhus och ur den extraherade vätskan kunde TTR-fibrer renas fram. Strukturerna av dessa fibrer studerade forskarteamet med kryoelektronmikroskopi.
Platta TTR-protein bygger upp fibrer
I ett första steg identifierade forskarna makrostrukturerna på fibrerna och såg att de bestod långa trådliknande strukturer, så kallade protofilament. Flera protofilament har sedan gått samman och bildat fibrer uppbyggda av två till fem protofilament.
– I vår studie karakteriserade vi strukturen av en fiber uppbyggd av två protofilament. Med kryoelektronmikroskopi kunde vi karakterisera strukturen ned på atomnivå, det vill säga en upplösning där positionerna av de enskilda atomerna i fibern kan detekteras, säger Elisabeth Sauer-Eriksson, professor på Kemiska institutionen vid Umeå universitet.
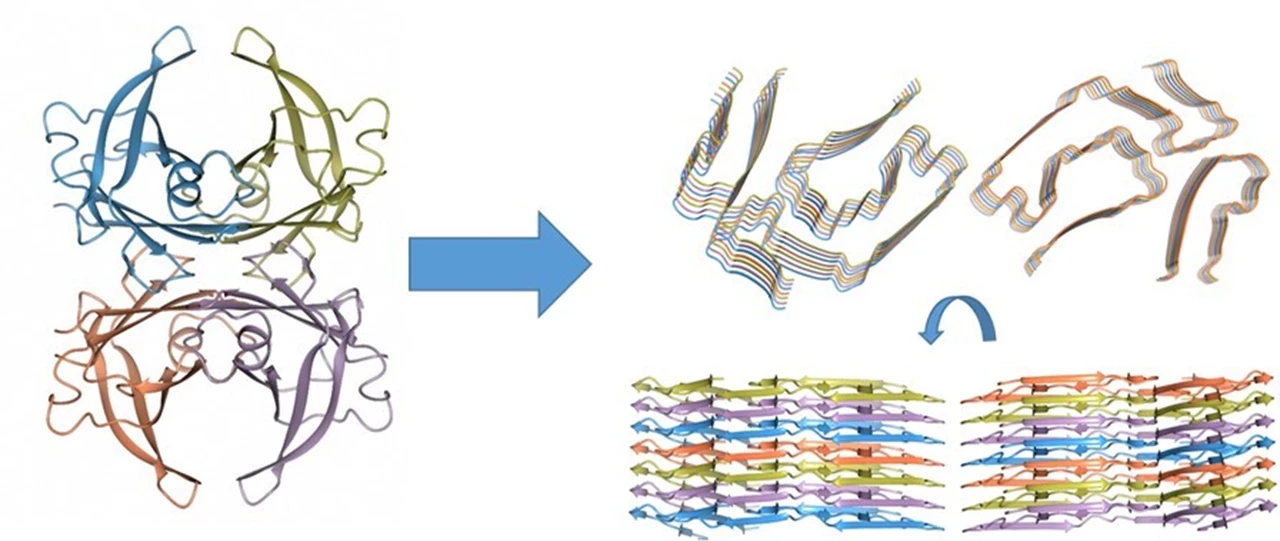
Humant lösligt TTR har en tredimensionell struktur, och är uppbyggd av fyra identiska proteinkedjor som packar samman i en så kallad tetramer. I fiberform är dock strukturen dramatiskt annorlunda. Tetrameren har dissocierat, och de fyra kedjorna har veckats om och bildar nu platta molekyler som sedan packas på varandra. Ett protofilament av en fiber består alltså av tusentals platta TTR-proteiner staplade på varandra.
Fibrer i ögat annan struktur
Strukturen av fibrer isolerade från glaskroppen jämfördes även med strukturer av fibrer framrenade från hjärta. Intressant nog är strukturerna lika men inte identiska.
– Det öppnar frågan om fiberstrukturerna är olika för att de bildats i olika organ, eller om de är olika för att de inte bildats i samma patient? Det är något vi avser att studera i framtiden, säger Irina Iakovleva, första forskningsingenjör på Kemiska institutionen vid Umeå universitet.
Irina Iakovleva och Elisabeth Sauer-Eriksson tror att studiens resultat kommer att bana väg för att amyloidfibrer kan utforskas som nya potentiella mål för diagnostik och terapeutiska strategier. I dag finns läkemedel som förhindrar bildning av amyloidfibrer, men vad som saknas och behöver utvecklas är läkemedel som bryter ner redan bildade amyloidfibrer. För den forskningen behövs kunskap om hur fibrernas struktur ser ut i detalj.
Till vänster strukturen av de fyra proteinkedjorna i den lösliga tetrameriska formen av TTR. Varje kedja har sin egen färg. När en fiber bildas måste tusentals tetramerer gå isär och kedjorna veckas om till platta strukturer som sedan packas på varandra. Bilden till höger visar två orienteringar av en kort sektion av fibern som består av 2-protofilament – vi ser den uppifrån och från sidan. Varje protofilament består här av sju proteinkedjor så 14 proteinkedjor totalt. Bild: Elisabeth Sauer-Eriksson
Experimenten utfördes på fibrer som avlägsnats med glaskroppskirurgi som tillhandahölls av Intissar Anan, forskare och läkare på Institutionen för folkhälsa och klinisk medicin vid Norrlands universitetssjukhus.
Forskningen har utförts i samarbete med flera forskargrupper som bidragit med sina olika kompetenser. Kryo-EM-data är insamlat vid den nationella forskningsinfrastrukturen Umeå Core Facility for Electron Microscopy (UCEM). Forskningen har finansierats med anslag från Vetenskapsrådet, Kempestiftelserna och Skelleftesjukas förening FAMY.
Om den vetenskapliga publikationen:
Iakovleva, I., Hall, M., Oelker, M., Sandblad, L., Anan, I. & Sauer-Eriksson, A.E.: Structural basis for transthyretin amyloid formation in vitreous body of the eye. Nature Communications 12, 7141 (2021).https://doi.org/10.1038/s41467-021-27481-4