Från biomarkörer till behandling – nya rön inom neurodegenerativ sjukdom
Nestorn i Sverige inom området demens, professor Bengt Winblad utser årligen en pristagare med tillhörande forskningsanslag till en person med framstående insatser inom Alzheimerforskningen. Professor Johan Lökk rapporterar från symposiet.
Ett flertal av de forskare som genom åren erhållit priset hade idag samlats på de ärevördiga lokalerna i Svenska Läkarsällskapets hus centralt i Stockholm till ett symposium för att presentera delar av sin forskning orkestrerat av Bengt Winblad och hans ständiga medarbetare Gunilla Johansson. En fantastisk möjlighet för den stora publiken som var både insatt, nyfiken och sökande om den stora folksjukdomen demens. Moderatorn Jens Berggren lyckades väl med att såväl binda ihop som att isolera de olika föreläsnings-sessionerna, som avslutades med små panelsamtal.
Alzheimersjukdomen karakteriseras ju av att det tar lång tid från en smygande debut, kliniska symtom till diagnos. Beror det på sjukdomens karaktär, den drabbade personen, anhöriga, läkaren/sjuksköterskan eller sjukvårdens system?
Dagens välmeriterade, rutinerade och pedagogiska föreläsare utgjorde verkligen en högkompetent sammansättning som en god representant för translationell forskning. Den inleddes med basal forskning av Lars Tjernberg, KI som ändå började med att ge en kort klinisk expose om Alzheimers sjukdom, enligt följande:
- Alzheimer är vanligaste demensformen.
- Globalt är 40 miljoner drabbade.
- Kostande beräknas till 100 miljarder/år.
- Åldern är största riskfaktorn.
Lars Tjernberg beskrev arbetet om beta- amyloid, som är ett viktigt protein med stor betydelse för patofysiologin vid Alzheimers sjukdom; var det finns, hur det veckar sig, ackumuleras. Proteinet är 38-43 aminosyror lång, aggregeras och blir toxiska, klyvs med gamma-sekretas i olika steg. Med olika bilderingstekniker har konstaterats att beta-amyloid föreligger presynaptiskt men ej postsynaptiskt. Beta-amyloid finns i lysosomer och orsakar läckage som leder till bildandet av toxiskt Tau. Nu har man lyckats visa ett förhindrande av den patologiska aggregeringen av beta-amyloid med olika tekniker som i förlängningen kan transponeras till råttstudier vilket är framtida forsknings steg.
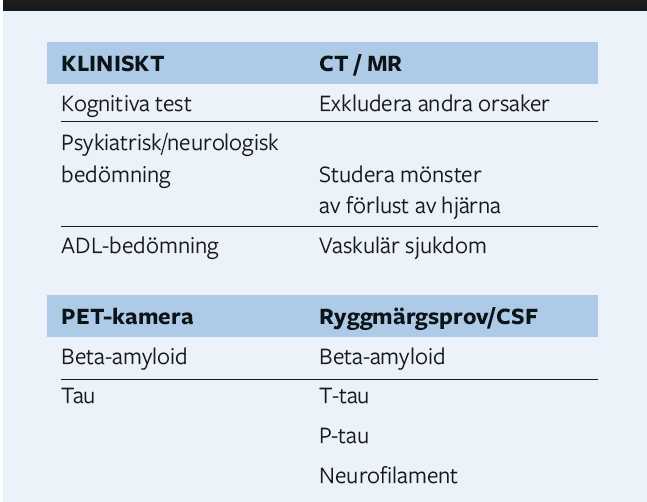
Bilden av hjärnan
Att kunna se in i hjärnan har alltid varit en önskan som från början gjordes med vanlig skall RTG över datortomografi till modern magnet (och – positronkamera) pratade Lars-Olov Wahlund, Karolinska Institutet. Datortomografi är enkel, snabb och billig medan MR är långsam, trång och dyr. Utvecklingen inom MR-området går framåt med olika styrkor på magnetfältet för att därmed öka upplösningen.
Vid MR och CT görs visuell bedömning av regional atrofi, tecken på arteriosklerotiska förändringar, vit substansförekomst medmera för att bedöma förekomst och grad av demens. Här mäts:
- MTA – medial temporal atrofi
- GCA – global cortical atrofi
- PA – posterior atrofi
- Fazekas vitsubstansgradering
Artificiell intelligens kan efterlikna visuell skattning av atrofi med matematiska och statistiska algoritmer, med teknisk maskininlärning och kommer framöver få mer betydelse. Man kan också beräkna så kallad ”Brain age” – hjärnans biologiska ålder med AI-tekniker. LOW presenterade en studie med avbildningar av 17 000 kognitivt friska försökspersoner och jämfört kronologiska åldern (X-axel) med predicerade hjärnåldern/brain age (Y-axel) och funnit att merparten finner sig i ett linjärt förhållande (mean absolute error 2,67 år) men att det finns avvikelser år båda hållen det vill säga ”older-aging brain”, ”younger-looking brain” och ”age-looking brain”.
Funktionell MR, fMR, har använts vid FTD, frontallobs demens, där sjukdomens symtom tangerar att påminna om många psykiska sjukdomar. Experimentell kan ses att hjärnan påverkas på likartade sätt vid dessa olika sjukdomar men också att vissa strukturer är släckta vid emotionella stimuli vid FTD medan den är intakt hos kontroller.
Upptäcks i tidiga stadier
Astrid Nordberg, KI pratade om olika spårmolekyler, hur man söker efter dessa och hur dessa kan vara till nytta för fortsatt användning, dess roll vid diagnosticering och för att följa ett förlopp. Positions emission tomografi är nyckelmetoden där man med visualisering av amyloid kan se förändringar redan i tidiga stadier av AD. Ämnet Tau, som är en annan biologisk markör vid AD, tycks vara svårare att visualisera än amyloid. Det tyck förekomma mer och mer spridd förekomst av Tau hos patienter med debut före 67 år än efter 67 år. Generellt tycks en rikligare förekomst av Tau implicera en gravare AD. I hjärnan finns en typ av celler som heter astrocyter som även tycks spela en roll vid AD. Man har idag kunnat notera en ökning av astrocyter –reaktiv astroglios– som predicerar AD och man har experimentellt kunnat mäta förekomsten indirekt i blod.
Svårt visualisera lösligt
Vid det efterföljande sessions-samtalet menade Lars-Olof Wahlund att han var mycket positiv till att använda AI framöver vid såväl diagnostik som uppföljning av demens fr a genom de extremt stora datamängder som AI använder. A.N. menade att PET undersökningar fortfarande är mycket dyra och kanske ska mer ses som ett komplement till andra undersökningar. Socialstyrelsen anger idag att PET skall enbart användas vid forskning av anledningen att det skall vara evidensbaserat, men en uppdatering av Soocialstyrelsen rekommendationer kan väntas som ändrar på detta. Dock kommer pågående och framtida användning av diagnosticerande blodprover bli en ”game-changer”. Den som kan finna möjlighet att visualisera lösliga föreningar i hjärnan har en av nycklarna till att enklare diagnosticera demens men detta är mycket komplicerat var samtliga föreläsare eniga om. Men att sätta diagnosen AD enbart grundat på avvikande biomarkörer är i nuläget helt fel menade L.T. Vad som startar hela demens-kaskaden i den sjuka hjärnan vet man ej, men man noterar att den visar sig först med patologin av amyloid, sedan dess nedbrytning och sedan tycks avvikelserna av tau följa. Primärvårdens roll i diagnosticeringen av demens är hittills att mäta en eventuell kognitiv nedsättning kliniskt och med skalan MMT (mini mental test) samt CT hjärna och därefter ta ställning till vidare utredning/remittering.
Biomarkörernas roll
Kay Blennow, Göteborg tog upp stafettpinnen om biomarkörer som han menade inte handlade om någon typ av graviditetstest om antingen positivt eller negativt, utan det är en pågående process man mäter. Cerebrospinal fluid test (CSF) visade vägen för AD diagnostiken som visar patologin med tau, fosforylerat tau och amyloid. Frågan om dess förändringar visar på demens kunde småningom visualiseras med olika typer av PET undersökningar av hjärnan med dessa biomarkörer. Genom en sammanläggning av dessa biomarkörer har man funnit en hög specificitet och sensitivitet redan vid predemens/kognitiv nedsättning. En annan biomarkör i CSF är neurogranin, som är ett synaptiskt protein och är ökat vid AD men även vid PSP, en annan neurodegenerativ sjukdom. Blodnivåerna av de kända biomarkörerna tycks inte i de flesta fall samvariera med CSF med undantag för en typ av fosforylerat tau.
Oskar Hansson, Lund menade att det kan vara svårt att diagnosticera demens då det finns en del imiterande sjukdomar. Kliniskt tycks 50 procent inte få diagnos. Historiskt var år 2020 det år när blodmarkörer för AD tog fart. Hur ska man då diagnosticera AD?
Höga nivåer av P-tau 127 i blod indikerar AD och tycks detektera AD lika bra som markör från CSF. Med anledning av att ha vaskat fram en blodmarkör med hög säkerhet att kunna predicera AD raljerade O.H. att det var början på slutet på hans karriär då han uppnått sitt mål. Dessutom kan automatiserade analysmetoder användas utan behov av manuell pipettering och provhantering. Man har även testat en process där patienten själv fyller i ett egenmaterial följt av blodprov och därefter analys och diagnos för att konstatera eller frikänna. Man har även undersökt och kunnat konstatera möjligheter att tidigt diagnosticera LewyBody sjukdom och Parkinsons sjukdom.
Arktisk mutation
Lars Lannfelt, Uppsala berättade den lyckosamma historien om den arktiska mutationen från ax till limpa det vill säga från experimentella arbeten till kliniskt tillämpbar terapi av AD. L.L.s ingång till sjukdomar har ofta varit genetisk där han initialt noterade förekomsten av oligomererna av beta-amyloid och dess inerta fibriller. Specifika antikroppar till prototofibriller av beta-amyloid och att undvika monomerer och fibriller visade sig småningom bli en framgångsrik väg till det som senare blev en kliniskt användbar vaccination efter de sedvanliga och tidsödande fas I-III studierna. Man fann en reduktion av plaquen i hjärnan genom terapi med antikroppen Lecanemab. En av svårigheterna var och är att få bättre och lättare tillgång till hjärnan trots blod-hjärnbarriären. Läkemedlet är numer godkänd i stora delar av världen och i Sverige. Forskningsmässigt och förhoppningsvis kommer framöver en tidig, kontinuerlig, lågintensiv terapi i subkutan form bli modellen för terapi vid AD.
I efterföljande föreläsarpanelen diskuterades framtida möjligheter till egenanvändning av en person genom att kunna sticka sig själv i fingertoppen för ett blodprov, skicka för analys och småningom diagnos. Man letar kontinuerligt efter andra blodmarkörer bl a för alfa-synuklein, som är patologiskt tongivande vid LBD och PD. Än så länge finns enbart i liten omfattning möjlighet till blodprov av P-tau127 på KS och i Göteborg. Däremot anger man som vårdgivare aldrig att personen har AD med ledning av biomarkörerna, utan man anger att personen har en ökad risk/mindre risk för att utveckla AD.
Superagers och deras hjärna
Lars Lannfelt raljerade och sade att i början av forskningen om AD så skiljde man på ”Baptister eller Tauister” det vill säga de som trodde på beta-amyloid eller tau när det gällde att hitta de patofysiologiska orsakerna. Ska man då screena bland generella blodprover för att hitta sjukdomen ? Svaret var lite avhängigt dels om personen har symtom och dels om man har något att erbjuda terapeutiskt. Och innan man tar ett prov, hur hanterar man ett positivt svar om demensrisk och hur förmedlas det till personen? Vid annan allmän screening för bland annat prostata- och mammarcancer finns det ju olika typer av terapier varför man som vårdgivare kan känna sig någorlunda trygg i att utfallet åt ena eller andra hållet gagnar patienten.
Vad utmärker äldre med välbehållna kognitiva funktioner var frågan från Lars Nyberg, Umeå. Vissa äldre personer har mycket god kognitiv förmåga visar studier från det s.k. betulaprojektet i Umeå. ”Superagers” förekommer och är ett kommande forskningsområde med definitionen:
- Mer än 80 år
- Episodiskt minne större än för 50-60 åringar
- God kognition i övrigt
”Superagers” tycks på visualiseringar av hjärnan uppvisa bättre bevarad hippocampus och bättre bevarad hjärna i allmänhet. Tack vare bland annat genetik och god ”brain reserve” i ung ålder och god variation i förändringstakt i ”brain maintenance” senare i livet och även ytterligare senare i livet uppvisa en god kombination i både ”brain reserve” och variation i ”brain maintenance” kan det indikera en framtida ”superager”. God utbildning under ungdomen och genetik i kombination predicerar en ”superager”, som underhålls med sociala kontakter, god mental hälsa, god sömn, andra gener, diet (medelhavskost, youghurt med bra gastro-intestinalt system). Desto viktigare är dessa uppgifter då äldre och äldre-äldre ökar över tid — 80+ år ökar från 143 miljoner 2019 till 425 miljoner 20250 med den tillgång eller de prövningar och utmaningar det innebär på person, anhöriga och samhälle.
Laura Fratiglioni från Karolinska Institutet har i sina studier funnit att 70 procent av undersökta fallen i studierna är mer än 75 år men alla är ej dementa. Hon framhöll vikten av prevention för att minska risken för att utveckla demens:
PRIMÄR PREVENTION (intakt mental förmåga): Primär prevention: ej röka, lite etyl, fysisk aktivitet, diet, viktkontroll, minska miljörisker.
SEKUNDÄR PREVENTION (mild kognitiv förmåga): Bevaka kardiometabola sjukdomar: högt BT, postural hypotoni, hjärtsvikt, förmaksflimmer, DM, fetma.
TERTIÄR PREVENTION (olika former av demens)
Annat: anemi, komorbiditet, minska stress?, engagera sig i sociala, fysiska och mentala aktiviteter med en kumulativ effekt under hela livet.
Symposiet avslutades med en gemensam paneldiskussion och stundtals debatt, med alla föreläsare, där vissa tyckte att virus betydelse vid demens ej har någon orsaksbetydelse utan det är genetiken som är framträdande. Det motsades av andra som angav att virus-spåret trots allt alltid har varit levande som orsak till Alzhemiers sjukdom, AD, fr.a. då herpesvirus tycks kunna utöva en genes antingen som en trigger eller en genuin orsak med oklar process. Nyligen har det ju visats att herpes-vaccination skulle kunna minska risken för framtida demens. Från publiken frågades om acetylkolin och dess möjligheter att tillföras för att förbättra AD då det ju föreligger en brist på ämnet vid AD. Forskningsspåret med acetykolin och dess betydelse vid AD har funnit med från början vid sjukdomens process menade A.N. Signalsubstansen har dock en mycket snabb omsättning på sekunder, vilket gör att specifika läkemedel med ämnet eller som skulle stimulera produktionen av acetylkolin är mycket svår och är inte aktuell.
Basal kunskap, tid och forskningsmöjlighet är grunden för att kunna komma framåt inom forskningen. Det måste finnas hos de enskilda forskarna och de studier som avses göras och inte enbart handla om registerforskning, menade Bengt Winblad. Det har ju alltid sagts till nya, aspirerande forskare att de måste vara motiverade, verkligen vilja och kunna avsätta tid. Generellt menade panelen att den kliniska verksamheten måste vara än mer öppen för forskning för att kunna driva och främja såväl forskning som klinik i riktning framåt, som i slutänden gynnar patient och samhälle. Viktigt är att det då även finns en övergripande myndighet som underlättar, bejakar och ratificerar forskning, givna data, erfarenheter och evidens.
Symposiet genomsyrades av en translationell och positivt framåtriktande väg inom området och hedrades med närvaron av HKH Drottning Silvia som deltagare i auditoriet. Det var nog fler än jag som skulle se fram emot ett liknande genomarbetat och välbesökt symposium framöver.