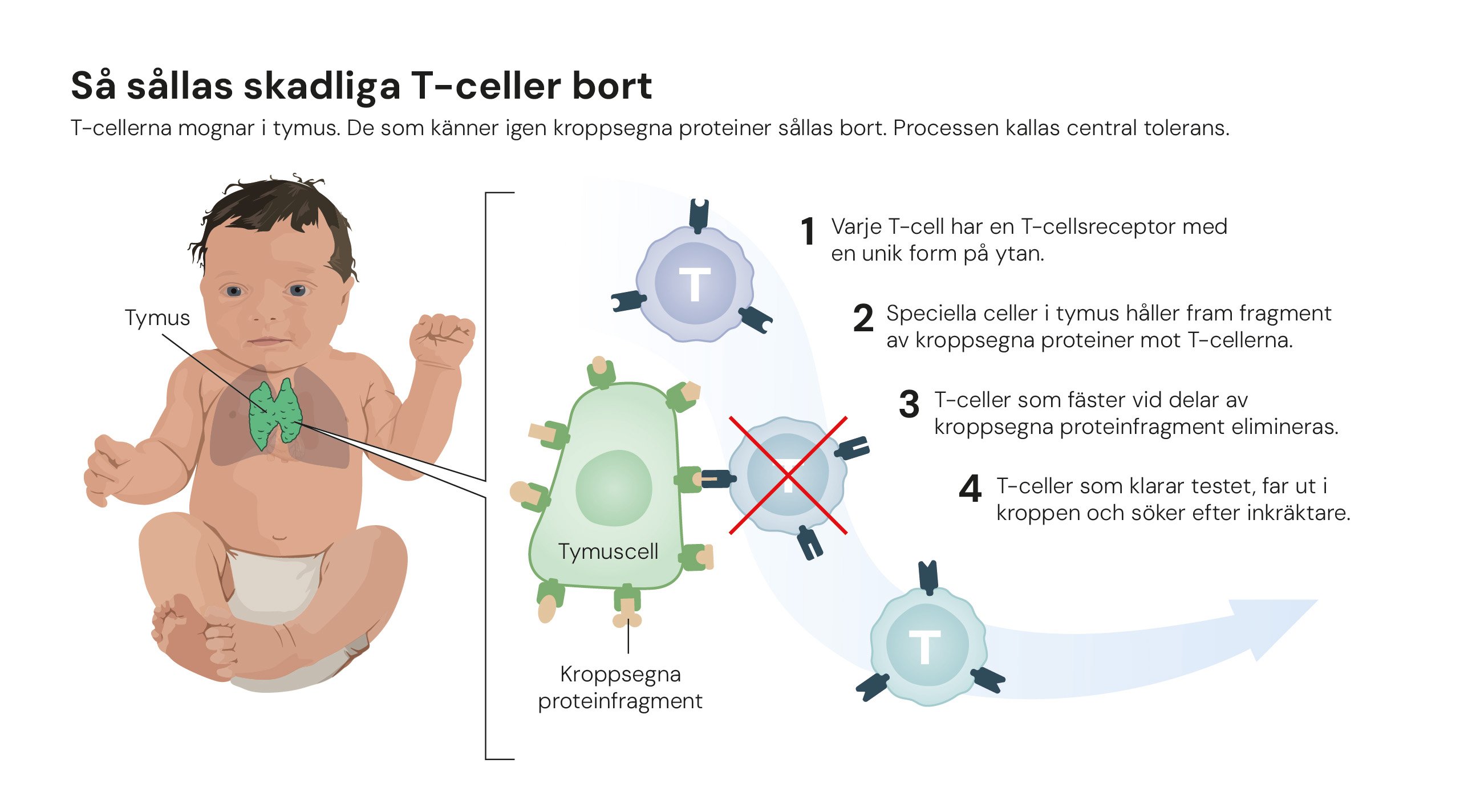
Kroppens immunförsvar skyddar oss dagligen mot infektioner och tumörer, men det måste hållas i noggrann balans. Om det överreagerar kan det börja angripa kroppens egna vävnader.
2025 års Nobelpris i fysiologi eller medicin tilldelas Mary E. Brunkow, Fred Ramsdell och Shimon Sakaguchi för deras banbrytande upptäckter av hur immunförsvaret reglerar sig självt genom så kallad perifer immuntolerans.
Pristagarna identifierade immunförsvarets egna ordningsvakter, de regulatoriska T-cellerna, som håller immunsystemet i schack och förhindrar skadliga autoimmuna reaktioner. Upptäckterna har fått avgörande betydelse för förståelsen av sjukdomar där immunförsvaret slår fel, och därtill öppnat nya vägar för behandling inom både autoimmuna tillstånd, neurologiska sjukdomar och cancer. Nya insikter som kan ge behandling för sjukdomar som ALS och MS.
– Deras upptäckter har varit avgörande för vår förståelse av hur immunförsvaret fungerar och varför vi inte alla får allvarliga autoimmuna sjukdomar, säger Olle Kämpe, ordförande i Nobelkommittén, i ett pressmeddelande från Karolinska Institutet.
När Shimon Sakaguchi 1995 identifierade en tidigare okänd klass av T-celler som skyddar kroppen från autoimmuna reaktioner utmanade han den dåvarande synen på att immunförsvarets tolerans enbart uppstår i thymus. Hans fynd visade att ett ytterligare skyddssystem finns ute i kroppen. Ett nätverk av celler som aktivt dämpar immunsvaret.
Mary Brunkow och Fred Ramsdell gjorde nästa avgörande upptäckt 2001, när de identifierade genen Foxp3, som visade sig styra utvecklingen av dessa T-celler. Mutationer i Foxp3 orsakar svåra autoimmuna sjukdomar, både hos möss och människor.
Två år senare kunde Sakaguchi knyta ihop resultaten och visa att Foxp3 är den genetiska nyckeln till utvecklingen av regulatoriska T-celler, vilka håller immunsystemet stabilt.
Upptäckterna har lagt grunden för ett nytt forskningsfält som nu påverkar utvecklingen av behandlingar mot flera sjukdomar där immunförsvaret är i obalans.
Inom neurologin har insikterna om immuntolerans fått betydelse för förståelsen av tillstånd som multipel skleros, MS, och autoimmun encefalit, där immunförsvaret angriper nervsystemet. Samtidigt utnyttjas samma mekanismer i cancerforskning, där forskare försöker påverka regulatoriska T-celler för att göra immunförsvaret mer effektivt mot tumörer.
Nobelpriset till Brunkow, Ramsdell och Sakaguchi belönar därför inte bara en grundläggande vetenskaplig upptäckt, utan också den breda medicinska betydelse den har fått för både diagnostik och framtida behandling av sjukdomar som påverkar kroppens mest komplexa system