Två sjukdomar som drabbar hjärnan, Parkinsons sjukdom och multipel systematrofi, kännetecknas av att samma protein klumpas ihop och skadar nervcellerna. Nu har forskare visat att spårarmolekyler utvecklade vid LiU kan skilja sjukdomarna åt. Forskarna hoppas att upptäckten på sikt kan leda till tidigare och säkrare molekylär diagnostik.
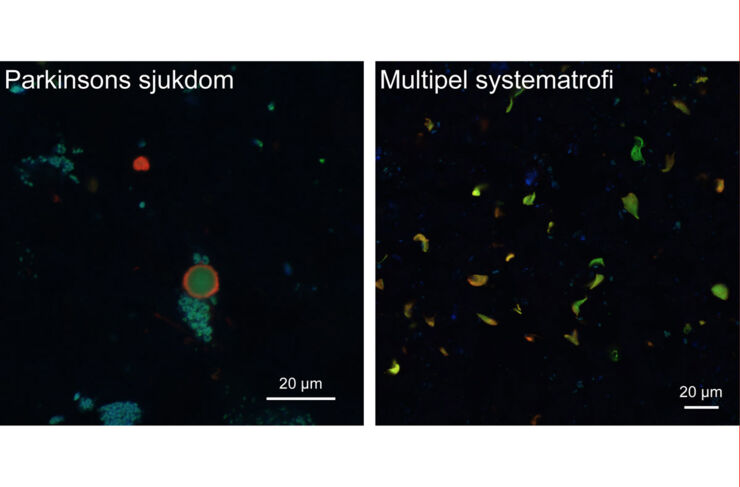
Aggregat av alfa-synuklein i celler i mänsklig hjärnvävnad som färgats in med spårarmolekyl (grön) och antikropp mot alfa-synuklein (röd). Den turkosa eller blå färgen kommer av ett annat ämne (lipofuscin) som ansamlas i åldrande hjärnceller, men som inte har någon betydelse för studiernas resultat. Foto: Therese Klingstedt
För en läkare som undersöker en person som har problem med skakningar, svårigheter med sina rörelser och påverkan på talet är det mycket svårt att ställa rätt diagnos. Sjukdomstecknen kan nämligen orsakas av både Parkinsons sjukdom och den mer ovanliga Multipel systematrofi, MSA. Båda sjukdomarna beror på att nerverna stegvis förtvinar i allt större områden i hjärnan. I båda sjukdomarna är det dessutom samma protein, alfa-synuklein, som får en felaktig form och ansamlas. MSA kan misstas för Parkinsons sjukdom till en början, men har ett snabbare sjukdomsförlopp och utvecklas på ett annat sätt. De kan också behöva olika behandling. I dag finns bara ett sätt att med säkerhet skilja sjukdomarna åt: att vänta och se hur symtomen utvecklas.
Nu har forskare hittat ett sätt att på ett tidigt stadium se skillnad på Parkinsons sjukdom och MSA. Spårarmolekyler som utvecklats av forskare vid LiU spelar en viktig roll. I ett samarbete med Claudio Sotos forskargrupp vid The University of Texas Health Science Center at Houston (UTHealth) har Peter Nilssons forskargrupp undersökt de aggregat av felveckat alfa-synuklein som är kännetecknande för båda sjukdomarna.
Skillnader på molekylnivå
I studien, som nyligen publicerades i Nature, tog de amerikanska forskarna prover från ryggmärgsvätskan från patienter som har antingen Parkinsons sjukdom eller MSA. Eftersom halterna av felveckat alfa-synuklein är mycket låga i ryggmärgsvätskan, använde forskarna sig av en metod som de utvecklat för att flerfaldiga mängden, ungefär som en kopieringsmaskin. De blandar en liten mängd protein från ett patientprov med den normala formen av alfa-synuklein. De felveckade proteinerna från patienten omvandlar då det normala alfa-synukleinproteinet så att det antar samma, felveckade struktur.
Forskarna använde sedan särskilda spårarmolekyler, som utvecklats av Peter Nilsson och hans kollegor, för att se om det är möjligt att spåra de skadliga proteinaggregaten med dem. Spårarmolekylerna har den speciella egenskapen att de kan lysa med olika färg beroende på den exakta formen hos proteinet som de binder till. Forskarna såg att färgen som spårarmolekylerna avgav skilde sig åt mellan proteinaggregaten i prover från personer med Parkinsons sjukdom jämfört med prover från de personer som hade MSA.

Peter Nilsson Foto: Karin Söderlund Leifler
– Det är första gången som vi har varit med och visat att våra spårarmolekyler fungerar på prover från ryggmärgsvätska från patienter. I studien har våra amerikanska forskarkollegor visat att även om båda proteinaggregaten innehåller alfa-synuklein, så har de olika struktur och skiljer sig åt mellan sjukdomarna, säger Peter Nilsson, professor vid Institutionen för fysik, kemi och biologi, IFM.
De amerikanska forskarna gick vidare med att titta på hur alfa-synukleinaggregaten ser ut med hjälp av kryoelektronmikroskopi. Det visade sig att proteinaggregaten i de båda sjukdomarna skiljer sig en del åt i sin kemiska struktur. Det fanns också skillnader i hur skadliga de var för celler som forskarna odlade i laboratoriet, där felveckat alfa-synuklein från MSA tycktes mer skadligt.
– Eftersom det verkar gå att använda spårarmolekylerna på ryggmärgsvätska hoppas vi att det här skulle kunna utvecklas till ett molekylärt diagnosverktyg för vården, kanske i kombination med en metod som flerfaldigar mängden protein, säger Peter Nilsson.
Tidigare diagnos
I en annan studie, som publicerades nyligen i tidskriften Acta Neuropathologica Communications, har forskarna tittat på hur aggregaten av alfa-synuklein ser ut i hjärnvävnad från avlidna personer, som haft antingen Parkinsons sjukdom eller MSA. Studien är ett samarbete med brittiska forskare och gjordes när Therése Klingstedt var postdoktor i Michel Goederts forskargrupp vid MRC Laboratory of Molecular Biology i Cambridge, Storbritannien. Även i denna studie användes LiU-forskarnas spårarmolekyler för att spåra felveckat alfa-synuklein.
Therese Klingstedt
– Eftersom våra spårarmolekyler ändrar färg beroende på proteinaggregatens struktur, kollade vi på vilken färg de avger när de binder till alfa-synukleinaggregat från personer med MSA respektive Parkinsons sjukdom. Vi såg att de fick olika färg och det tyder på att det är olika struktur på proteinaggregaten, säger Therése Klingstedt, förste forskningsingenjör vid IFM.
Båda studierna stöder alltså teorin att det går att se skillnad på de felveckade proteinernas struktur och på så sätt skilja de båda sjukdomarna åt, både genom analys av hjärnvävnad och ryggmärgsvätska.
Tidigare forskning har pekat på att aggregaten av alfa-synuklein verkar börja formas flera år eller årtionden innan den drabbade får kliniska symtom. Möjligheten att spåra de felveckade proteinerna i ryggmärgsvätska är särskilt intressant, menar Peter Nilsson.
– Det öppnar möjligheten att ställa rätt diagnos medan sjukdomen pågår. Tidig diagnos är en viktig aspekt när det gäller medicinering och annan typ av behandling. Metoden skulle även kunna användas för att utvärdera effekten av ny potentiella läkemedel mot sjukdomarna.
De amerikanska forskarna har patenterat sin proteinamplifieringsmetod och grundat ett företag som kommersialiserar den.
Artiklarna:
“Discriminating α-synuclein strains in Parkinson’s disease and multiple system atrophy”, Mohammad Shahnawaz, Abhisek Mukherjee, Sandra Pritzkow, Nicolas Mendez, Prakruti Rabadia, Xiangan Liu, Bo Hu, Ann Schmeichel, Wolfgang Singer, Gang Wu, Ah-Lim Tsai, Hamid Shirani, K. Peter R. Nilsson, Phillip A. Low och Claudio Soto, (2020), Nature, publicerad online 5 februari 2020, doi: 10.1038/s41586-020-1984-7
“Luminescent conjugated oligothiophenes distinguish between α-synuclein assemblies of Parkinson’s disease and multiple system atrophy”, Therése Klingstedt, Bernardino Ghetti, Janice L. Holton, Helen Ling, K. Peter R. Nilsson och Michel Goedert, (2019), Acta Neuropathologica Communications, publicerad online 3 december 2019, doi: 10.1186/s40478-019-0840-1


