Den första behandlingen med nytt Magnetkameraguidat Fokusert Ultraljud (FUS) utanför USA har utförts på Norrlands universitetssjukhus. Med den avancerade tekniken kan man utföra neurokirurgiska ingrepp i hjärnans centrala delar utan att öppna hud eller skallben.
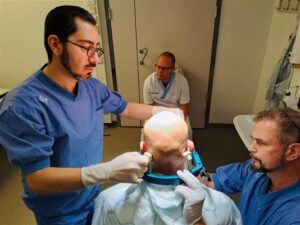
Patienten förbereds inför behandlingen. Från vänster: neurokirurg Amar Awad, sjuksköterskan Tommy Hellqvist samt överläkare Patric Blomstedt. Foto: Rasmus Stenmark Persson.
Maskinen används för att behandla ofrivilliga skakningar så kallad tremor, essentiell tremor och Parkinsons sjukdom.
– Det är fantastiskt att Norrlands universitetssjukhus har köpt maskinen och att vi nu är först utanför USA med att genomföra den första framgångsrika behandlingen i Sverige, säger Patric Blomstedt, överläkare och professor i stereotaktisk och funktionell neurokirurgi.
Den nya maskinen gör det möjligt att se de delar av hjärnan som behandlas med hög detaljrikedom och kontrollera behandlingen i realtid med hjälp av dessa bilder.
Den första patienten
Den första patienten var en medelålders man som sedan många år lider av ofrivilliga skakningar i händerna. Skakningar gör det svårt att äta, dricka, skriva och klara andra uppgifter i vardagen. Essentiell tremor är en folksjukdom som drabbar 0,5 procent av befolkningen och som blir vanligare med högre ålder. 5 procent av alla över 65 år lider av denna åkomma.
Skakningarna är mycket handikappande och mediciner hjälper endast hälften av patienterna. För de övriga har öppen hjärnkirurgi hittills varit det enda alternativet, men det passar inte alla, särskilt inte äldre och sköra patienter.
Metoden innebär att patienten placeras i en magnetkamera med en ultraljudshjälm. Området, punkten, som ger upphov till skakningarna identifieras med hjälp av bilder från magnetkameran och fler än 1 000 ultraljudskällor riktas mot denna punkt under drygt 10 sekunder. Där dessa sammanstrålar ökar värmen och ett 1–3 millimeter stort området inaktiveras. Men först testas effekten med lägre temperatur för att undvika eventuella biverkningar.
Tekniken har funnits i cirka tio år men aldrig använts i Sverige. Det är först nu, med den andra generationen av FUS-maskiner som lanserades 2024, som utvecklingen har tagit ett stort steg framåt.
– Patienten som är vaken under ingreppet känner framför allt att det blir lite varmare i skalpen, som därför kyls med vatten. Behandlingen av vår första patient gick mycket bra och han kunde pigg och mycket nöjd konstatera att den hade haft en väldigt god effekt, säger Patric Blomstedt.

Patric Blomstedt. Foto Region Västerbotten
Stor och omedelbar effekt
Effekten är omedelbar och patienten kan åka hem dagen efter behandlingen. För den aktuelle patienten minskade skakningarna med cirka 90 procent och inga komplikationer eller biverkningar uppstod.
Den unika behandlingen gjordes vid enheten för Deep Brain Stimulation i samarbete med centrum för funktionell hjärnavbildning samt forskningsmagnetkameran på Norrlands universitetssjukhus. Enheten är ett av världens ledande centra för stereotaktisk funktionell neurokirurgi, som nu också kan erbjuda behandlingen till patienter från hela landet.
Med Region Västerbottens strategiska investering kan många patienter som tidigare lämnats utan behandling nu få hjälp. Förhoppningen är att nya studier kan vidga indikationerna så att även patienter med andra tillstånd kan få hjälp av metoden.